カペシタビンクルカ - カペシタビンとは何ですか?
カペシタビンクルカは、有効成分カペシタビンを含む薬です。 それはタブレットとして利用可能です(150、300および500 mg)。
カペシタビンクルカは「ジェネリックハイブリッド医療」です。 これは、カペシタビンクルカが同じ有効成分を含んでいるが、既存のものに加えて新しい投与量で利用可能である「参照薬」に似ていることを意味します。 参照薬であるXelodaは150および500 mgの錠剤で入手可能ですが、Capecitabine Krkaは300 mgの錠剤としても入手可能です。
カペシタビンクルカ - カペシタビンは何のために使用されますか?
カペシタビンクルカは以下の治療に適応される抗がん剤です:
- 大腸がん(大腸)。 カペシタビンクルカは、「III期」または「C期デュークス」結腸がんの手術を受けている患者に、他の抗がん剤との併用または単独療法として(単独で)適応されます。
- 転移性結腸直腸がん(体の他の部分に拡がっている大腸がん)。 カペシタビンクルカは、他の抗がん剤との併用または単独療法として適応されます。
進行胃(胃)癌。 カペシタビンクルカは、シスプラチンなどのプラチナ含有抗がん剤を含む他の抗がん剤との併用で適応となります。
- 局所進行または転移性の乳がん(体の他の部分に拡がり始めた乳がん)。 カペシタビンクルカは、アントラサイクリン(別の種類の抗がん剤)によるネガティブ治療後のドセタキセル(別の種類の抗がん剤)との併用で適応されます。 アントラサイクリンとタキサンの治療(他の種類の抗がん剤)が効かなかった場合や、それ以上のアントラサイクリン療法が適切でない患者さんでは、単独療法でも使用できます。
薬は処方箋によってのみ得ることができます。
Capecitabine Krka - Capecitabineはどのように使用されますか?
カペシタビンクルカは、抗がん剤の使用資格のある医師によってのみ処方されるべきです。
カペシタビンクルカは、(患者の体重と身長に基づいて計算して)体表面積1平方メートルあたり625〜1 250 mgの用量で1日2回投与されます。 投与量は治療する腫瘍の種類によって異なります。 医師は、患者が服用すべき150、300、および500 mg錠の数を計算します。 カペシタビンクルカ錠は、食事の30分以内に水と一緒に服用してください。
治療は結腸手術後6ヶ月間続きます。 他の種類の癌では、疾患が悪化した場合、または患者が治療に耐えられない場合、治療は中止されます。 肝臓または腎臓病の患者さんや特定の副作用のある人さんでは、用量を調整する必要があります。
詳細は製品特性の要約にも記載されています(EPARにも含まれています)。
Capecitabine Krka - Capecitabineはどのように機能しますか?
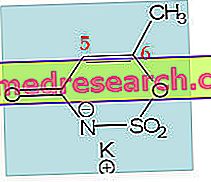
カペシタビンクルカの有効成分であるカペシタビンは、「代謝拮抗物質」のグループに属する細胞毒性薬(がん細胞など、分裂する細胞を殺すことができる薬)です。 カペシタビンは体内で5-フルオロウラシル(5-FU)に変換される「プロドラッグ」です。 しかしながら、それは正常組織におけるよりも腫瘍細胞においてより多く変換される。 それは錠剤として扱われますが、5-FUは通常注射されるべきです。
5 − FUはピリミジンの類似体である。 ピリミジンは細胞の遺伝物質(DNAとRNA)の成分です。 体内では、5-FUがピリミジンに取って代わり、新しいDNAの生産に関与する酵素と干渉します。 このようにして、それは癌細胞の増殖を阻害し、そしてそれらの死を引き起こす。
カペシタビンクルカ - カペシタビンはどのように研究されていますか?
同社は、この医薬品の生物学的同等性を判断するための研究から得られたデータを、参照医薬品であるXelodaと比較しました。 2種類の薬は、体内で同じレベルの有効成分を生成する場合、生物学的に同等です。
カペシタビンクルカ - カペシタビンの利点とリスクは何ですか?
カペシタビンクルカは標準薬と生物学的に同等であるため、その利点とリスクは標準薬と同じであると見なされます。
カペシタビンクルカ - カペシタビンが承認されたのはなぜですか?
CHMPは、EUの要件に従って、カペシタビンクルカは同等の品質を持ち、Xelodaと生物学的に同等であることが示されていると結論付けました。 したがって、CHMPは、Xelodaの場合と同様に、ベネフィットが特定されたリスクを上回ると考え、Capecitabine Krkaの販売承認を推奨しました。
カペシタビンクルカ - カペシタビンに関する追加情報
2012年4月20日、欧州委員会はカペシタビンクルカの販売許可を発行しました。これは欧州連合全体で有効です。
カペシタビンクルカ療法の詳細については、パッケージリーフレット(またEPARの一部)を読むか、医師または薬剤師に連絡してください。
この要約の最終更新日:2012年3月3日。