一般性
多発性骨髄腫は、免疫系の特定の細胞に影響を及ぼし、さまざまな臓器や組織に損傷を与える悪性腫瘍です。 それは一般的に50歳以上の人々に発症し、しばしば痛み、骨折および骨破壊を伴います。
多発性骨髄腫は、血液検査、骨髄検査、尿中タンパク質電気泳動、および放射線検査で診断されます。 疾患の寛解は、ステロイド、化学療法、プロテアソーム阻害剤、免疫調節薬(サリドマイドまたはレナリドマイドなど)および幹細胞移植で誘発されます。
原因
多発性骨髄腫を引き起こす原因は一部不明です。 医学的統計から、電離放射線または特定の化学物質(石油誘導体および他の炭化水素、溶剤、農薬、アスベストなど)にさらされた被験者の発生率が増加することが発見されました。 家族遺伝因子、反復抗原刺激およびウイルス剤もまた、多発性骨髄腫の病因に関与し得る。
症状
もっと知るために:多発性骨髄腫の症状
多発性骨髄腫は主に老年期(50歳以上)に発生します。 多くの臓器が病気の影響を受ける可能性があるため、徴候や症状は人によって大きく異なります。 発症時には、この状態によって症状が引き起こされることはありません。 疾患が進行するにつれて、形質細胞臓器浸潤およびモノクローナル免疫グロブリンの過剰産生に関連する症状が発生する可能性があります。
- 骨が痛い。 骨痛は多発性骨髄腫患者の約70%が罹患しており、最も一般的な症状です。 それは主に背骨、骨盤、肋骨、長骨と頭蓋骨にあります。 初期の総体的症状は「偽性外傷性」であるが、急性かつ持続性の局所的疼痛は病的骨折を示す可能性がある。 椎骨の関与は脊髄圧迫につながる可能性があります。 多発性骨髄腫では、骨の損傷は、髄腔内の骨髄腫形質細胞の増殖に関連する「溶菌性」型の病変および骨減少症の出現に続発する。 実際、多発性骨髄腫の細胞は、再吸収によって破骨細胞が骨組織の破壊を促進することを可能にする様々な因子(宗派OAF、破骨細胞活性化因子にまとめられている)を産生する。 骨芽細胞(「骨産生細胞」)は同じ増殖刺激を受けないので、骨量は次第に減少する。 これは組織の構造を変化させ、骨を壊れやすくし、骨折、骨粗鬆症および挫滅(椎骨)を起こしやすくします。 放射線学的な観点からは、骨の再配置は、「穿孔された」斑点の出現により明白であり、これは骨凝縮が存在しない領域と一致する。 骨病変が増加すると、血中のカルシウムの放出も増加します(高カルシウム血症)。
- 高カルシウム血症 血中の高レベルのカルシウムは神経機能に影響を及ぼし、過度ののどの渇き、悪心、便秘、食欲不振および精神的混乱を引き起こします。 高カルシウム血症は悪性細胞の骨への浸潤によるものです。
- 腎不全 腎臓機能の調整にはいくつかの要因が介在します。 高レベルの異常な免疫グロブリン、単クローン性異常(タンパク質?M)は、糸球体(Bence Jones proteinurea)へのそれらの沈着の後に尿細管病変を引き起こし得る。 骨吸収の増加は高カルシウム血症を引き起こし、そして腎石灰化症を引き起こし、したがって腎不全の一因となる。 他の原因としては、高尿酸血症性腎症(尿酸の沈着による)、腫瘍細胞の局所浸潤、再発性感染症(腎盂腎炎)およびアミロイドーシスが挙げられる。
- 貧血。 多発性骨髄腫では、赤血球の欠乏は骨髄内の腫瘍クローンに有利な「健康な」血球の産生の失敗に起因します。 貧血は、無力症、全般的な脱力感および呼吸困難を引き起こします。
多発性骨髄腫に共通するこれら4つの問題は、頭字語CRABと呼ばれることが多く、カルシウム、腎不全、貧血および骨損傷のレベルを意味します。→C = カルシウム (上昇)、R = 腎不全 、A = 貧血 、 B = 骨病変
多発性骨髄腫の他の徴候や症状には以下のものがあります:
- 感染症 :白血球の減少(白血球減少症)は免疫不全につながり、それゆえ感染に対する抵抗力が低下します。 これらは異なる臨床的重症度(肺炎、副鼻腔炎、皮膚の感染症、膀胱または腎臓)であり得、そして多発性骨髄腫患者の主な死因となり得る。 感染症の発症に対する最大のリスクの期間には、化学療法開始後の最初の数ヶ月が含まれます。
- 止血の変化 :血小板の欠乏(血小板減少症)は凝固過程に変化を引き起こし、それは出血するという顕著な傾向を示します。 全体として、血小板半減期は減少し、そして血管内皮との相互作用は変化する。 止血の他の異常は、線維素溶解の減少から生じる。
- 過粘稠度症候群 :多発性骨髄腫の場合によっては、血漿粘度の値が上昇し、出血症状、神経障害および冠状虚血を引き起こします。
- 神経学的疾患 :多発性骨髄腫に関連する神経学的症状は不均一です。 神経炎性疼痛の出現および四肢の脱力感またはしびれが最も一般的な症状です。 最後に、椎骨の関与、または末梢神経レベルでのアミロイド沈着物の浸潤によって引き起こされる手根管症候群および他の神経障害による根本的な痛みおよび脊髄圧迫があるかもしれません。
診断
医師は、定期的な健康診断の際に行われる血液検査および尿検査を通して、多発性骨髄腫の徴候を検出できます。 患者が無症候性の場合は、これらの臨床検査を定期的に繰り返して、疾患の進行を監視し、治療を開始するのに最適な時期を判断します。 臓器病変は多発性骨髄腫の重要な診断基準です。
実験室テスト
多くの場合、 血球数によって貧血の存在が確認されます(Hb <10g / dl)。 末梢血塗抹標本は、増加した血漿粘度の結果として、積み重ねられた赤血球(赤血球)を示す。 多くの場合、好中球減少症と血小板減少症が共存しており、これらは疾患の末期に悪化します。
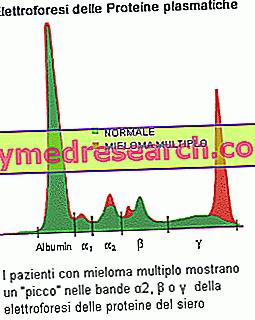
血清タンパク質の電気泳動は 、腫瘍クローンによって産生されるパラタンパク質の存在を実証することができる:バンド(ピーク)が電気泳動プロファイルに関連し、成分M> 30g / Lである場合、骨髄腫の疑いがあると考えられる。 もう一つの一般的な所見は、モノクローナルタイプの軽鎖からなるパラタンパク質が尿中に存在することを特徴とする、 Bence Jonesのタンパク尿です 。 M成分の定量的測定は、多発性骨髄腫の診断を確立しそして疾患を監視するために必要である。 血液検査では、赤血球沈降速度(ESR)が上昇し、カルシウムレベル(進行性多発性骨髄腫の人で上昇)、アルブミン(進行性骨髄腫に関連する低レベル)、尿酸(尿酸血症)、クレアチニン(増加)が変化します腎機能の低下による) 骨髄腫形質細胞によって産生される別のタンパク質であるβ-2-microglobulinの存在を確認するために、他の検査を行うこともあります。 これは患者の病期分類において有用な指標となり得る:高レベルはより進行した疾患およびより悪い予後を示す。
イメージング技術
放射線学的調査は骨格の関与を示している。 磁気共鳴画像法は、溶解性病変の検出において標準的なX線撮影法よりも高感度であり、そして骨再配列の存在を早期に定義することができる。
骨髄検査
骨髄検査は多数の形質細胞を示します:多発性骨髄腫の定義のための診断要件は腫瘍クローンの量が10%以上であるということです。 サンプルの一部もまた、従来の細胞遺伝学または蛍光インサイチュハイブリダイゼーション技術(FISH)の使用によって、特徴的な核型変化の存在を評価するために試験される。 多発性骨髄腫に最も頻繁に見られる染色体異常は、染色体1、3、5、11、13および14を含む。特に、染色体13のモノソミーは、高い増殖速度および薬剤耐性と関連する生存率の低下と相関する。
病期分類および予後
診断検査は多発性骨髄腫の臨床像を確認することができます。 さらに、これらの検査の結果から、医師はステージ1、2、または3の疾患を分類することができます。ステージ3の骨髄腫の人は、より多くの腫瘍クローンや腎不全を含む1つまたは複数の進行疾患の徴候を示します。 さらに、骨髄生検の結果、医師は患者の全体的なリスクプロファイルを決定し、最良の治療計画を立てることができます。
| 多発性骨髄腫の病期分類(Durie-Salmonによる) | ||
| 臨床病期 | パラメータ | 腫瘍量(細胞数) |
| ステージ1 | 以下のすべて
| <0.5×1012 /㎡ |
| ステージ2 | ステージIおよびIIIの基準のどれも | 0, 5-1, 2x1012 /㎡ |
| ステージ3 | 次のうちの1つ以上
| > 1, 2x1012 /㎡ |
Durie-Salmon病期分類システムの病期1、2および3は、血清クレアチニンに応じて、さらにAまたはBに分類することができます。
- A:クレアチニン血症<2 mg / dl(<177 mmol / L)
- B:血清クレアチニン> 2 mg / dl(> 177 micromol / L)
最近、 国際多発性骨髄腫病期分類システムと呼ばれる別の病期分類システムが提案されている。
骨髄腫の国際予後指標(International Staging System - 2005発行) | ||
スタジアム | 基準 | 平均生存期間(月) |
ザ・ |
| 62 |
II | h 42 - ミクログロブリン<3.5 mg / Lおよびアルブミン<3.5 g / dl 若しくは 血清アルブミンとは無関係のβ2-microglobulin 3.5-5.5 mg / L | 44 |
III | β2 - ミクログロブリン≧5.5 mg / L | 29 |
治療
もっと知るために:多発性骨髄腫の治療薬
多発性骨髄腫の治療は、クローン集団を減らす治療法に集中しています。 疾患が完全に無症状である場合、管理は臨床的観察に限定されます。 症状がある場合、治療は痛みを和らげ、合併症を抑制し、病状を安定させ、そして腫瘍の進行を遅らせるのに役立ちます。
第一選択療法
近年、自家造血幹細胞移植を伴う大量化学療法(自家移植)が、65歳未満の患者にとって最も適切な治療選択肢となっています。 移植の前に、最初の1サイクルの導入化学療法が行われ、それによって新生物量が減少する。 最も一般的に使用されるレジメンは、サリドマイド(+デキサメタゾン)、ボルテゾミブおよびレナリドマイド(+デキサメタゾン)の投与を含みます。 高用量の化学療法と幹細胞支援(自己移植)による治療は治癒的ではありませんが、全生存期間を延ばし、完全寛解を決定することができます。 同種幹細胞移植、すなわち健常人から罹患患者への移植は、可能性のある治療法であるが、臨床的症例のごく一部にしか利用できない。 65歳以上で重症の併発疾患を有する患者は、しばしば幹細胞移植に耐えることができません。 これらの人々のために、標準的な治療はしばしば6週間毎に繰り返されるサイクルの後の休止期間に続くプレドニゾン(5-10日間)に関連したメルファランとの化学療法(4〜7日間)を伴います。 一部の患者では、このプロトコルと、例えばボルテゾミブ投与を含む新しい治療計画との関連付けが有用な場合があります。 この薬はプロテアソーム阻害剤(すべての細胞に存在する多タンパク質複合体)であり、それは難治性または急速に進行する疾患を有する患者における完全な臨床反応を可能にする。 ボルテゾミブの作用機序は、腫瘍細胞におけるアポトーシスの誘導に基づいており、プロテオソームの作用を遮断している。 有意な臨床反応が症例の約50%に見られる
支持療法
多発性骨髄腫の直接治療に加えて、ビスフォスフォネート(例えば、パミドロネートまたはゾレドロン酸)が定期的に投与されて溶解性病変を制御し、骨折を予防する。 赤血球ベースの輸血およびエリスロポエチンは貧血に関連する症状を矯正するのに有用であり、一方、血小板濃縮物の投与は血小板減少症によって引き起こされる出血を予防することができる。 抗カルシウム薬が感染症の管理に役立つ一方で、ステロイドとビスフォスフォネートも高カルシウム血症の危機の治療において重要になります。