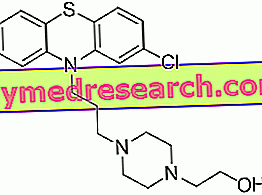
Stayveer - Bosentanは何に使用され、それは何に使用されますか?
Stayveerは活性物質ボセンタンを含む薬です。 それは運動能力と症状を改善するためにクラスIIIの肺動脈高血圧症(PAH)患者の治療に適応されます。 PAHは、肺動脈内の圧力が高い病的状態である。 「クラス」は病気の重症度を示します:「クラスIII」は身体活動の強い制限を含みます。 PAHは次のとおりです。
- 一次(特定されたまたは家族の原因なしで);
- 強皮症(または進行性全身性硬化症、皮膚および他の臓器を支える結合組織の異常増殖を特徴とする状態)によって引き起こされる。
- 先天性心不全(出生時からの存在)が原因で、シャント(気道奇形)があり、心臓と肺の間に異常な血流が生じます。
- 改善はPAHクラスIIの患者でも観察されています。 「クラスII」は身体活動のわずかな制限を含みます。 Stayveerはまた、進行性の全身性硬化症の成人にも使用できます。この疾患では、血液循環が悪いために「指の潰瘍」(指やつま先の炎症)が発生します。 Stayveerの目的は、新しいデジタル潰瘍の数を減らすことです。
この薬はすでに欧州連合(EU)で承認されているTracleerと同じです。 Tracleerを製造している会社は、自社の科学データをStayveerに使用できることに同意しています(「インフォームド・コンセント」)。
Stayveer - Bosentanはどのように使用されていますか?
Stayveerは処方箋によってのみ得ることができ、治療はPAHまたは進行性全身性硬化症の治療の経験がある医師によって開始および監視されるべきです。 Stayveerは錠剤(62.5 mgと125 mg)として入手可能で、水と一緒に飲み込まなければなりません。 錠剤は朝と夕方に服用する必要があります。 成人では、開始用量は4週間で1日2回62.5 mgで、その後1日2回125 mgの通常用量に増やされます。 PAHの小児では、使用される用量は体重に基づいて計算されるべきであり、通常1日2回キログラムあたり2mgから始まります。 詳しくは、パッケージのリーフレットを参照してください。 医師は、Stayveerに対する患者の反応を評価し、進行中のデジタル潰瘍を伴う進行性全身性硬化症患者では定期的にと同様に改善を報告していないPAH患者で8週間後にさらなる治療を続ける必要性を判断する。 医師がStayveerによる治療を中止すると決めた場合は、用量を徐々に減らしてください。 Stayveerで治療された患者は、薬の安全性に関する主な情報をまとめた特別な覚書を与えられなければなりません。
Stayveer - Bosentanはどのように機能しますか?
Stayveerの有効成分であるボセンタンは、血管の狭窄を引き起こすエンドセリン-1(ET-1)と呼ばれる天然に存在するホルモンを阻害します。 したがって、Stayveerは血管の拡張を決定します。 PAHは肺の血管の深刻な狭窄が発生する衰弱性疾患です。 それは心臓の右側から肺に血液を運ぶ血管の中で非常に高い血圧を引き起こします。 この圧力は血液が肺に持ち込むことができる酸素の量を減らし、身体活動をより困難にします。 これらの血管を拡張することで、血圧が下がり、症状が改善されます。 進行性の全身性硬化症および進行中のデジタル潰瘍の患者では、ボセンタンは指やつま先の血行を改善し、新しいデジタル潰瘍の発症を防ぎます。
研究中にStayveer - Bosentanはどのような利点を示しましたか?
PAHでは、Stayveerが4つの主な研究で研究されています:クラスIIIまたはIVのPAHを有する成人、強皮症に起因する合計245人の成人を対象とした2件の研究。先天性心不全、ならびにクラスIIのPAH患者185人の研究。 スタディベアとプラセボ(身体に影響を与えない物質)を比較した研究では、どちらも標準治療に追加されました。 有効性の主な尺度は、患者が6分で歩くことができる距離(運動能力を測定する方法)でした。 しかし、クラスIIの疾患に関する研究では、肺血管の血流抵抗の変化(血管狭窄の指標)も調べました。 原発性または強皮症が原因のPAHクラスIIIまたはIVでは、2つの研究により、Stayveerで治療した患者は16週間の治療後にプラセボで治療した患者よりも長い距離をカバーできることが明らかになりました。サイズが大きい)。 しかし、クラスIVのPAH患者の数は少なすぎて、このグループの薬の使用を支持することはできませんでした。 先天性心不全の患者にも同様の結果が現れた。 クラスIIのPAH患者では、Stayveerは6ヵ月の治療後にプラセボと比較して23%血管抵抗の減少を誘導したが、患者が6分で歩くことができる距離は2つのグループで同様であった。 3〜15歳の19人の小児および青年についても研究が行われ、心臓および動脈に関連するパラメータの改善が観察されました。 指潰瘍を伴う進行性全身性硬化症の場合、2件の研究で合計312人の成人においてStayveerとプラセボが比較された。 有効性の主な尺度は、研究中に発症した新しいデジタル潰瘍の数に基づいていました。 1件の研究では、190人の患者の回復に対するStayveerの効果も調べ、各患者で特定のデジタル潰瘍の完全な治癒を達成するのに必要な時間を測定しました。 Stayveerはプラセボよりも新しいデジタル潰瘍の形成を減らす効果がありました。 最初の研究では、Stayveerを服用している患者は、プラセボ治療を受けた患者の2.7人の潰瘍と比較して、16週後に平均1.4人の新しい指潰瘍を報告しました。 同様の結果が24週間の治療の後の第2の研究で観察されました、しかし、Stayveerは指の潰瘍の治癒に影響を及ぼしませんでした。
Stayveer - Bosentanに関連するリスクは何ですか?
PAHでは、Stayveerの最も一般的な副作用(10人に1人以上が罹患する可能性があります)は、頭痛と異常な肝機能検査です。 指潰瘍のある患者では、Stayveerの最も一般的な副作用(10人に1人以上に影響を及ぼす可能性があります)は、肝機能検査の異常、浮腫および水分貯留です。 肝臓の問題を発症する危険性を考えると、あなたの医者は治療の前と毎月の滞在中に肝酵素レベルを測定します。 Stayveerで報告されたすべての副作用の完全なリストについては、Package Leafletを参照してください。 肝臓に問題がある患者、信頼できる避妊方法を使用していない妊娠中または出産年齢の女性、またはシクロスポリンA(免疫系に作用する薬)で治療されている患者にはStayveerを使用しないでください。 制限事項の一覧については、パッケージのリーフレットを参照してください。
なぜStayveer - Bosentanが承認されたのですか?
庁の人間用医薬品製造委員会(CHMP)は、Stayveerの利益はそのリスクより大きいと判断し、EUでの使用が承認されることを推奨しました。
Stayveer - Bosentanの安全で効果的な使用を確保するためにどのような対策が取られていますか?
Stayveerができるだけ安全に使用されるように、リスク管理計画が策定されています。 この計画に基づいて、医療従事者および患者が従うべき適切な予防措置を含む、安全性情報がStayveerの製品特性およびパッケージリーフレットの要約に含まれています。 さらに、Stayveerの安全性を説明するために(特に肝臓への影響および妊娠中の)、Stayveerを製造する会社は、各加盟国の処方者用の情報キットおよび患者用の情報リーフレットを提供します。彼のやりとり 同社はまた、各加盟国における医薬品の流通状況を慎重に監視し、進行性の全身性硬化症患者における継続的なデジタル潰瘍を伴うその使用に関する情報を収集することを約束します。
Stayveer - Bosentanに関するさらに詳しい情報
2013年6月24日に、欧州委員会はStayveerに対して欧州連合全体で有効な販売許可を承認しました。 Stayveerによる治療の詳細については、パッケージリーフレット(またはEPARの一部)を読むか、医師または薬剤師に連絡してください。 この要約の最終更新日:06-2013。