ミオシン
ミオシンは筋原線維のモーターです。 各分子は6つのサブユニットから成り、そのうち2つは同一の重鎖で、非常に大きく、2対の小さな軽鎖です。
重いタンパク質鎖は絡み合って末端テール、剛直、らせん状、および2つの球形頭部を形成する。
2本の軽鎖タンパク質が各頭部の重鎖と会合している。

太いフィラメントの中では、ミオシンの様々なアイソフォームが頭部を四肢に露出するように組織化されている一方で、尾部は束によって中央領域にまとめられている。 頭と尾の間の接合部は、収縮中に頭が曲がるのを可能にする柔軟な首(ヒンジ)です。
球状部分は、重いメロミオシンとも呼ばれ、一方、末端部分は、軽いメロミオシンとして知られている。
ミオシン球状頭部は、「ロープ」として作用するアクチンの細いフィラメントとの相互作用を媒介する横方向の架橋を形成する。
収縮の現象は2つの段階に分けることができます。
1)太いフィラメントと細いフィラメントとの間の結合(クロスブリッジの形成)。
2)フィラメントスライディング
述べたように、架橋の形成は繊維内部のカルシウムの活性の増加に依存する。 ATPとの結合に割り当てられたポケットのミオシンの頭部における存在、ならびにそれをADPおよび無機リン酸に分解してエネルギーを放出することができる酵素(ATPアーゼ)の存在もまた基本的である。
アクチン
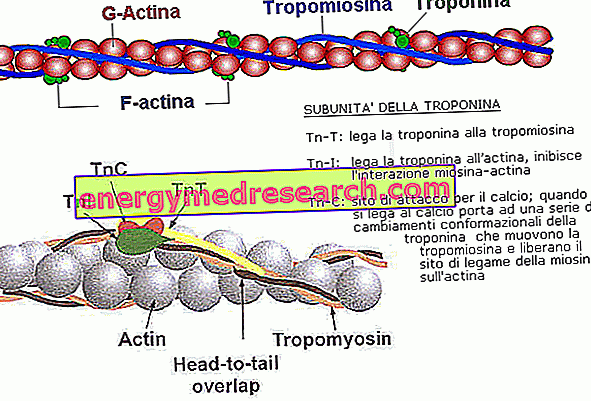
サルコメアの細い鎖を形成するアクチンは球形のタンパク質で、球形に似た形をしています(Gアクチン)。 これらの分子の多くは互いに会合して長く細い顆粒(Fアクチンと呼ばれる)を構成しています。 これらの鎖のうちの2本は、2本の真珠のネックレスのように上下に重なって、細いフィラメントを生み出します。
各G-アクチン分子は、ミオシンヘッドのための結合部位を含み、それは休止状態では、実際には2つのタンパク質によってブロックされている。 細いフィラメントは実際にはアクチンだけでなく以下によって構成されています。
- トロポミオシン:安静時の筋肉では、7つのG-アクチン分子とそれぞれのミオシン頭部との接触を防ぎ、筋肉をリラックスさせます。
- トロポニン:カルシウムと結合すると立体構造を変化させ、トロポミオシンを動かしてミオシンとカップリングさせます。
これらのタンパク質に加えて、筋肉筋原線維には以下のものが含まれます。
安定化および収縮中の筋節の中心合わせの機能を有するチチン、コネクチンおよびネブリン。



