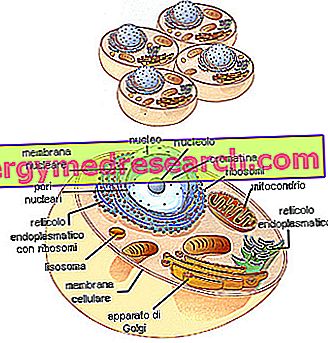
ジェネリック医薬品とは何ですか?
ジェネリック医薬品は、すでに承認されている医薬品(いわゆる「参照医薬品」)に似た医薬品です。 ジェネリック医薬品には、参照医薬品と同じ量の有効成分(または有効成分)が含まれています。 ジェネリック医薬品とリファレンス医薬品は同時に使用されます
同じ病気を治療するための投与量で、同様に安全で効果的です。
ジェネリック医薬品の名称、外観(色や形など)および包装は、標準薬とは異なります。 さらに、ジェネリック医薬品はさまざまな不活性成分を含むことがあります。 すべての医薬品と同様に、不活性成分に特別な注意を払う必要がある場合は、これらの注意事項を医薬品のラベルおよび小冊子に記載する必要があります。
ジェネリック医薬品はどのように認可されていますか?
ジェネリック医薬品は、他の医薬品と同様に、販売する前に販売承認を取得する必要があります。 EMEAなどの規制当局が医薬品の有効性、安全性および品質について科学的評価を行った後に、販売承認が付与されます。
革新的な医薬品では、データ保護が保証されている期間が医薬品に関する法律で義務付けられています。 この期間の終わりに、製薬会社は後発医薬品の販売承認申請を提出することができます。
ジェネリック医薬品はどのように評価されますか?
参照医薬品は数年間承認されているので、この主題に関する情報はすでに入手可能であり、したがって新しい情報は必要ありません。 この法律は、ジェネリック医薬品が参照医薬品と同じくらい安全で効果的であることを示すためにどのテストを実施するべきかを定めています。 ほとんどの場合、生物学的同等性試験によって提供された情報で十分です。 生物学的同等性試験は、人がジェネリック薬を服用するか参照薬を服用するかにかかわらず、人体に存在する有効成分の量が同じであることを実証することを目的とした研究です。
後発医薬品は、他のすべての医薬品と同じ品質基準に従って製造されています。
さらに、他のすべての医薬品と同様に、規制当局は現場または製造現場で定期検査を実施しています。
ジェネリック医薬品の安全性は監視されていますか?
ジェネリック医薬品を含むすべての医薬品の安全性は、販売許可が発行された後も監視されています。 各企業は、市場に出す製品の安全性を監視するためのシステムを設定する必要があります。 規制当局もこの監視システムを検査することができます。 一般的に、参照薬を服用するときに特定の予防措置が必要な場合は、同じ予防措置を後発医薬品にも適用する必要があります。