Zavescaとは何ですか?
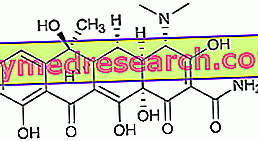
Zavescaは白い100 mgカプセルとして入手可能な有効成分miglustatを含む薬です。
Zavescaは何のために使用されていますか?
Zavescaは、体が脂肪を代謝する方法に影響を与える2つのまれな遺伝性疾患を治療することが示されています。 どちらの疾患も脂肪物質(グルコスフィンゴ脂質と呼ばれる)を体内に蓄積させます。 Zavescaは次のような場合に使用されます。
- 軽度から中等度の1型ゴーシェ病の成人。 苦しんでいる患者は酵素(グルコセレブロシダーゼ)を欠いています。 この欠乏症は、体のさまざまな部分での一種のスフィンゴ糖脂質(グルコシルセラミドと呼ばれる)の蓄積を決定します。 脾臓、肝臓、骨 ザベスカは、標準的な酵素補充療法(ERT)による輸液(静脈への滴下)による治療に適していない患者に使用されます。
- 成人、青年、およびニーマンピックC型疾患(子供の体内のスフィンゴ糖脂質の蓄積が脳内および他の部分の細胞に発生する可能性がある疾患)の子供。 Zavescaは、この疾患の「神経学的」症状(脳や神経に関する症状)の治療に使用されています。 これらの症状には以下が含まれます:協調の喪失、視力障害、発達遅滞、嚥下困難、筋緊張の亢進、痙攣および学習困難を引き起こす可能性がある「サッケード」(急速)眼球運動に起因する問題。
これらの病気を患っている患者の数が少ないので、それらは「まれ」と考えられ、それ故Zavescaは2000年10月18日にそれぞれ「孤児医学」の指定を受けました、1型ゴーシェ病と16 2006年2月、ニーマンピックC型疾患。
薬は処方箋によってのみ得ることができます。
Zavescaはどのように使われていますか?
Zavescaによる治療は、ゴーシェ病またはニーマンピックC型病の管理に経験のある医師によって開始および監視されるべきです。
1型ゴーシェ病患者を治療するための推奨開始用量は、1日3回、1カプセルを経口投与することです。 C型ニーマンピック病に関しては、成人および青年期患者に推奨される用量は1日2回、2カプセルです。 インクルード
投与量は、12歳未満の子供の体重と身長によって異なります。 Zavescaは満腹または空腹時に服用できます。 Zavescaは長期療法薬です。
投与量は腎臓の問題を抱えている患者で、そして少なくとも一時的に下痢を発症している患者では減らすべきです。 この薬の研究は、肝臓の問題のある患者では行われていません。 詳しくは、製品特性の要約(EPARに含まれています)を参照してください。
Zavescaはどのように機能しますか?
Zavescaの活性物質miglustatは、グルコシルセラミドシンターゼと呼ばれる酵素の作用を阻害します。 この酵素はスフィンゴ糖脂質生産の第一段階の一部です。 酵素の作用を防ぐことによって、ミグスタットは細胞内のスフィンゴ糖脂質の産生を減少させることができる。 これは1型ゴーシェ病の症状を遅らせまたは予防し、ニーマンピックC型疾患の症状を軽減するはずです。
Zavescaでどんな研究が行われましたか?
軽度から中等度の1型ゴーシェ病の治療におけるZavescaの有効性は、酵素補充療法を受けられない、または受けたくない28人の患者が関わる主な研究の主題でした。 研究の主要部分は1年間続いた。 患者のうち13人はさらに2年間薬を服用し続けた。 この研究は、肝臓と脾臓の体積に対するZavescaの効果を測定し、それがヘモグロビン(体内に酸素を運んでいる赤血球に見られるタンパク質)の濃度のような血液値に影響を及ぼしたかどうかを決定することを目的としました血小板数(血液凝固に関与する成分)。
ニーマンピックC型疾患に関しては、ザベスカの有効性が31人の患者を対象とした本研究で研究され、そのうち12人は12歳未満でした。 この研究では、Zavescaの効果を標準治療(症状を緩和するために使用される措置)および標準治療のみと比較しました。 主な有効性指標は、1年後の水平サッカード眼球運動の頻度の患者の変化でした。 この研究ではまた、患者の嚥下能力やその知的機能を含む他の神経学的症状も調べられました。 何人かの患者は5年半まで治療を受け続けた。 Zavescaで治療された66人の患者についても調査が行われました。
研究中にZavescaはどのような利点を示しましたか?
1型ゴーシェ病に関する研究では、1年後に肝臓の容積が12%、脾臓の容積が19%減少しました。 1デシリットル当たり0.26gのヘモグロビン濃度の平均増加、ならびに1ミリリットル当たり8.29百万の血小板数の増加もまた検出された。 Zavescaの有益な効果は、3年間の継続的治療を通じて変わっていません。
ニーマンピックC型疾患の研究において、眼球運動の改善はZavescaの有無で治療された患者で同様でした。 しかしながら、Zavescaで治療された患者には、嚥下能力と知的機能の改善の兆候が見られました。 調査は、薬が症状の悪化を安定させるか、または患者の約4分の3の間減少させたことを示しました。
Zavescaに関連するリスクは何ですか?
Zavescaに関連する最も一般的な副作用(10人に1人以上の患者に見られる)は、体重減少、振戦、下痢、鼓腸および腹痛(腹痛)です。 Zavescaで報告されているすべての副作用の完全なリストについては、Package Leafletを参照してください。
ザベスカはミグスタットまたは他の成分のどれにも過敏(アレルギー)であるかもしれない患者に使用されるべきではありません。
なぜZavescaは承認されたのですか?
人体用医薬品委員会(CHMP)は、不適切な成人患者における軽度または中等度の1型ゴーシェ病の治療に関するリスクを、ザベスカが示す利点よりも大きいと判断しました。 Niemann-Pick C型疾患の成人および小児患者における酵素補充療法(ERT)および進行性神経学的症状の治療を受けることを検討しているため、委員会はZavescaの販売承認の承認を推奨した。
Zavescaは、「例外的な状況下で」承認されました。というのも、まれな病気なので、薬に関する完全なデータを入手することが不可能だからです。 欧州医薬品庁(EMEA)は、その間に利用可能になった新しいデータを検討するために毎年進み、必要に応じてこの要約を更新します。
Zavescaにはまだどんな情報が待っていますか?
Zavescaの製造業者は、1型ゴーシェ病に関して製品の有効性と安全性に関して以下の研究を行うことを約束している:
- Zavescaの使用について医師に通知し、患者が薬の安全面を確実に報告するようにするための、製品の販売後のプログラム。
- 臨床試験に既に参加している患者を対象とした追跡調査。医学の安全性と有効性の評価を継続するとともに、疾患の神経学的側面についてより多くのフィードバックを得ます。
- 酵素補充療法後にザベスカに移行した患者におけるザベスカの有効性と安全性に関する研究
- ゴーシェ病に関するヨーロッパのワーキンググループ(EWGGD)と共同で行われた、この疾患の自然史に関するさらなる研究。
Zavescaに関するさらに詳しい情報:
2002年11月20日に、欧州委員会は、アクテリオン登録株式会社にザベスカの販売許可を発行しました。これは欧州連合全体で有効です。 販売承認は2007年11月20日に更新されました。
Zavescaのオーファンドラッグの状態の登録についてはここをクリックしてください(1型ゴーシェ病のために)そしてここ(Niemann-Pick type C病のために)。
Zavescaの完全なEPARについては、ここをクリックしてください。
この要約の最終更新日:2009年1月1日